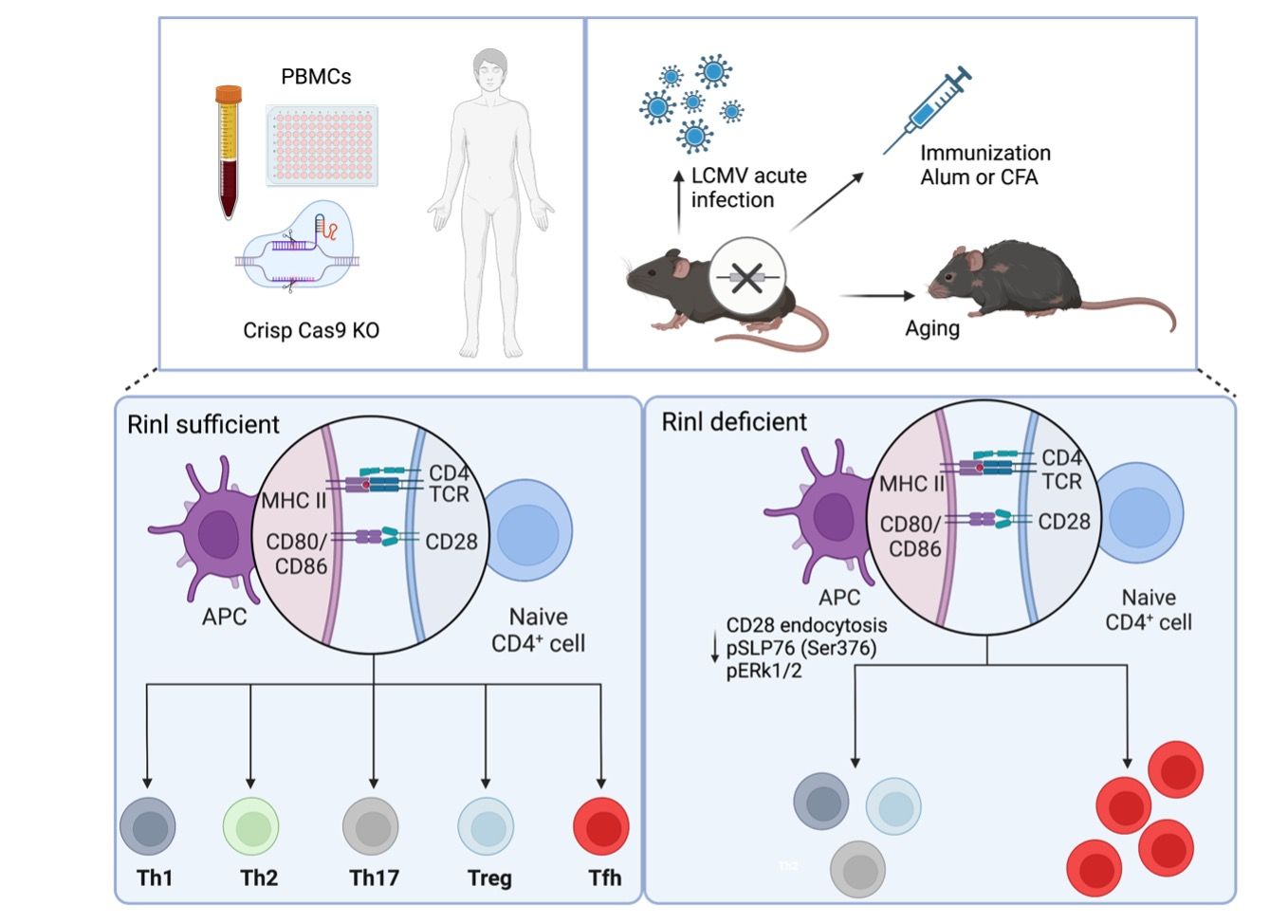
Molekulare Bestimmungsfaktoren für die Differenzierung von naïven CD4+ T-Zellen der Maus und des Menschen in follikulären T-Helferzellen und T-Zell-Hilfe für die B-Zell-Reifung und den Antikörperklassenwechsel.
Tfh-Zellen kommunizieren mit Ihrer Umwelt über sogenannte Rezeptoren. Das sind Proteine, die an der Zelloberfläche sitzen, Signale aus der Umgebung wahrnehmen und diese in das Zellinnere weiterleiten. Somit werden Zellvorgänge gesteuert, wie beispielsweise die Zellteilung und Vermehrung oder auch die Freisetzung neuer Botenstoffe, die dann von anderen Zellen über Rezeptoren wahrgenommen werden können. Deshalb ist die Regulation und Feinsteuerung der Oberflächenexpression von Rezeptoren eine wichtige Kontrollschnittstelle, um die Kommunikation zwischen Zellen und deren Umgebung zu steuern. Einer dieser Regulationsschritte erfolgt durch den sogenannten „Endozytosevorgang“, der bewirkt, dass Rezeptoren von der Zelloberfläche entfernt und in das Zellinnere geschickt werden. Gleichzeitig können so im Zellinneren auch wieder neue Signalwege geöffnet werden und die Zelle kann ihre Bestimmung ändern.
Eine Proteinfamilie, die Endozytosevorgänge steuern kann, wird von den RIN-Proteinen (Rin1, Rin2, Rin3 und Rin-like) gebildet. Rin-like (Rinl) wurde im Labor von Prof.in Ruth Herbst entdeckt und identifiziert. In einer aktuellen Studie konnte wir zeigen, dass Rinl-Endozytose von einem für T Zellen wichtigen Rezeptor, den CD28 Ko-rezeptor, reguliert. Damit waren auch Veränderungen im Signalweg des CD28 Ko-Rezeptor verbunden, die die Entwicklung von Tfh-Zellen regulieren. Wir konnten zeigen, dass Rinl ein wichtiger Hemmer der Tfh-Entstehung/-Bestimmung darstellt, sowohl während einer Immunisierung, einem viralen Infekt oder in einem Alterungsprozess. Somit konnten wir neue Mechanismen der Tfh-Entstehung aufdecken mit wichtigen Konsequenzen für menschliche Erkrankungen wie rheumatoide Arthritis oder spezifische Lymphome.
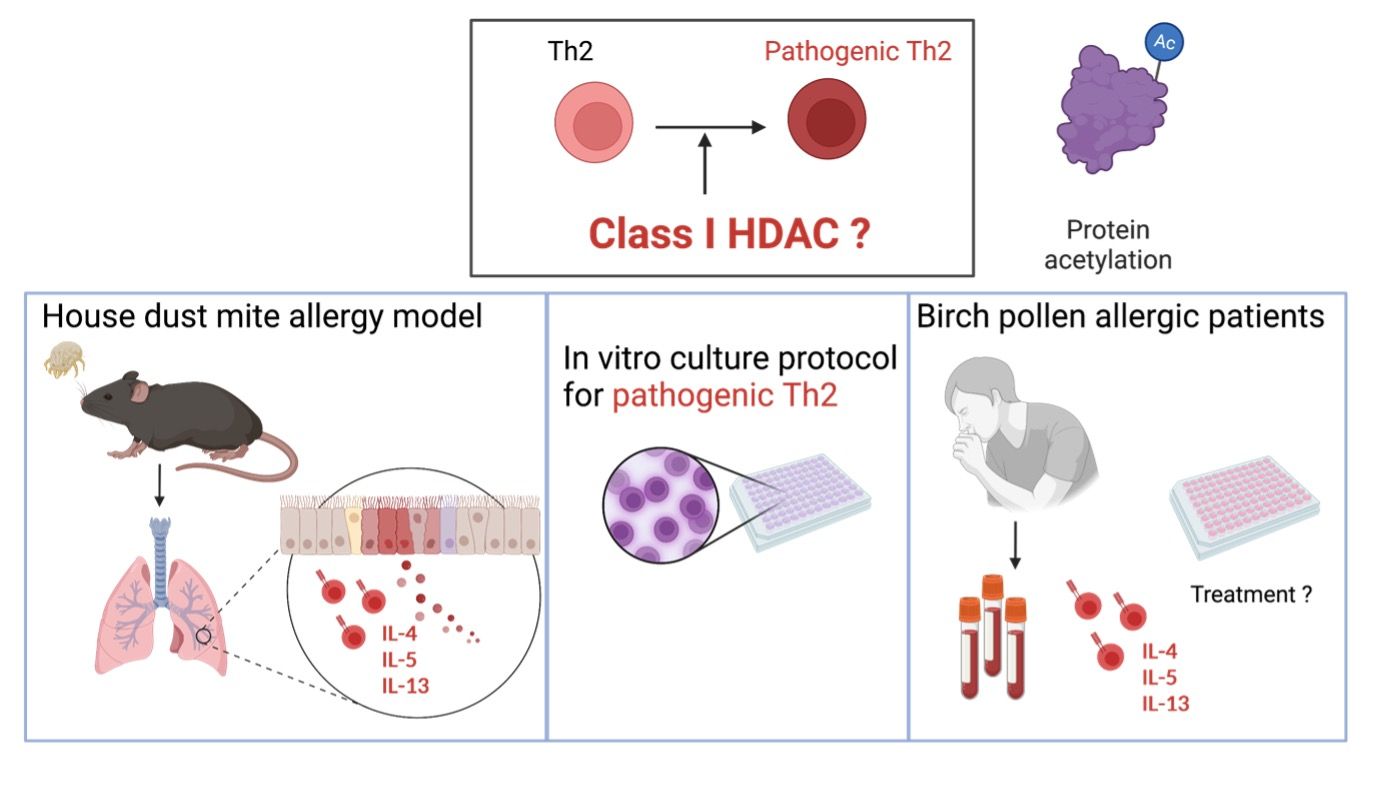
Gewebeanpassung von Th2-Effektorzellen während allergischer Atemwegserkrankungen, mit besonderem Interesse daran, wie Klasse I HDAC-Inhibition diesen Prozess reguliert.
Pathogene T-Helferzellen vom Typ 2 (pTh2) wurden als Hauptursache für allergisches Asthma in der Lunge identifiziert. Es bleiben jedoch grundlegende Fragen hinsichtlich ihrer Heterogenität, Signaturen und molekularen Regulation offen. Eine wesentliche Einschränkung unseres Verständnisses der molekularen Mechanismen, die pTh2-Zellen regulieren, ist das Fehlen eines geeigneten Systems, um sie in vitro zu erzeugen und zu untersuchen. Es ist bekannt, dass die Differenzierung und Effektorfunktionen von Immunzellen durch epigenetische Prozesse wie die reversible Lysinacetylierung, die durch Histonacetyltransferasen und Histondeacetylasen (HDACs) gesteuert wird, streng reguliert werden. HDAC1, eine Histon-Deacetylase der Klasse I, ist ein wichtiger epigenetischer Regulator von T-Zellen, seine Rolle in pTh2-Zellen muss jedoch noch bestimmt werden. Mittels eines Hausstaubmilbenmodells für allergisches Asthma, der Einzelzell-RNA-Sequenzierung (scRNA-seq) von Lungen-CD4+-T-Zellen und Mäusen mit einer T-Zell-spezifischen Deletion von HDAC1 decken wir hier die Heterogenität und Signaturen muriner pTh2-Zellen auf und die Rolle von HDAC1 in diesen Zellen. Unsere Analysen zeigen zwei unterschiedliche Untergruppen von Lungen-pTh2-Zellen: pathogene Effektor-Th2-Zellen (peTh2) und geweberesidente Th2-Gedächtniszellen (Th2 Trm). Beide pTh2-Zelluntergruppen sind stark proinflammatorisch und weisen im Vergleich zu anderen Lungen-Th-Untergruppen unterschiedliche transkriptionelle und phänotypische Signaturen auf. Anhand unserer scRNA-seq-Analyse identifizieren wir Bedingungen für die Erzeugung von pTh2-Zellen in vitro und bestätigen, dass diese in vitro erzeugten Zellen ein ähnliches Transkriptionsprofil wie Lungen-peTh2-Zellen aufweisen.
Verwendete Methoden: Krankheitsmodelle in Mäusen, Mehrfarben-Durchflusszytometrie, genetische Ansätze in der Maus, primäre Zellkulturtechniken (CD4+ T-Zellkulturen aus menschlichen und Mausproben), Proteomik und Hochdurchsatzsequenzierung.
Kooperationen
Dirk Baumjohan
Christoph Bock
Barbara Bohle
Michael Bonelli
Clarissa Campbell
Wilfried Ellmeier
Michelle Epstein
Iris Gratz
Markus Hartl
Johan Henriksson
Ruth Herbst
Matteo Iannacone
Karl Kuchler
Mirela Kuka
Thomas Krausgruber
Shinya Sakaguchi
Klaus Schmetterer
Michael Trauner